استفاده از ریزجلبکها برای از بین بردن آنتی بیوتیکهای فاضلاب
- منتشر شده در پنج شنبه, 01 خرداد 1399 17:16

انتشار آنتیبیوتیکها در محیط زیست منجر به توسعه تحقیقات در زمینه فناوریهای مؤثر در حذف آنتیبیوتیک از فاضلابها شده است. فناوریهای رایج مانند فرایندهای لجن فعال برای حذف آنتیبیوتیکها کارآمد نیستند. اخیراً فناوری مبتنی بر ریزجلبک بهعنوان یک جایگزین بالقوه برای تصفیه فاضلابهای حاوی آنتیبیوتیکها همراه با فرایندهای جذب، تجمع، تجزیه بیولوژیکی، تجزیه نوری و هیدرولیز مورد بررسی قرار گرفته است.
در این گزارش مواردی مانند اثر سمیت آنتیبیوتیک ها بر روی ریزجلبک ها، ساز و کارهای حذف آنتیبیوتیک توسط ریزجلبک ها و ادغام ریزجلبک ها با فناوریهای دیگر مانند تابش ماوراء بنفش (فوتوکاتالیز)، اکسیداسیون پیشرفته و تجزیه زیستی با میکروارگانیسمهای مکمل برای حذف آنتیبیوتیک مورد بحث قرار گرفته است. محدودیتهای فعلی موجود در فناوری مبتنی بر ریزجلبک و نیازهای تحقیقاتی آینده نیز مورد بحث قرار گرفته است.
آنتیبیوتیک ها معمولاً برای درمان و جلوگیری از عفونتهای باکتریایی استفاده میشوند. آنتیبیوتیک هایی مانند پنیسیلین ها، سولفونامید ها، cephalosporins ،macrolides و کینولونها بهطور گسترده درکشورهای در حال توسعه با افزایش 36 درصدی بین سالهای 2000 تا 2010 مورد استفاده قرار گرفتهاند.
تصفیهخانه های فاضلاب (WWTPs) منابع اصلی انتشار آنتیبیوتیک ها به محیط زیست هستند. با توجه به طبیعت ضدباکتریایی آنتیبیوتیک ها بسیاری از آنها نمیتوانند بهطور مؤثر توسط لجن فعال فاضلاب (تجمعی از گروهی از باکتریها) در WWTPsها حذف شوند. بسیاری از فرایندها مانند جذب، اکسیداسیون پیشرفته و فوتوکاتالیز برای حذف آنتیبیوتیک ها مورد مطالعه قرار گرفتهاند.
بازده جذب آنتیبیوتیک ها با استفاده از فرایند جذب به شدت به جاذب وابسته است که جاذبها معمولاً گران هستند. فرایندهای اکسیداسیون پیشرفته و فوتوکاتالیز ممکن است در کل مؤثر باشند اما علاوه بر تولید احتمالی آلایندههای ثانویه، به مواد شیمیایی یا کاتالیزورهای گرانقیمت نیاز دارند. از طرفی فرایند تصفیه فاضلاب مبتنی بر ریزجلبک فرایندی بیولوژیکی است که به مواد شیمیایی کمی نیاز دارد و میتواند برای حذف مؤثر آلایندههای نوظهور مانند آنتیبیوتیک ها مهندسی شود.
اخیراً فناوری مبتنی بر ریزجلبک بهعنوان روشی مؤثر در تصفیه پسابهای شهری و صنعتی گزارش شده است که دارای مزایایی از قبیل تثبیت دیاکسید کربن، حذف آلایندهها، صرفهجویی در ورودی مواد مغذی و پتانسیل توسعه محصولات مشتقشده از میکروجلبکهاست. استفاده از فناوری مبتنی بر ریزجلبک همچنین برای تصفیه آب یا پسابهای حاوی محصولات دارویی و مراقبتهای شخصی (PPCPs) گزارش شده است. مطالعات نشان دادهاند که ریزجلبک ها میتوانند PPCPهایی مانند آنتیبیوتیک ها را بهطور مؤثر از فاضلابها حذف کنند.
بهعنوان مثال یک حوضچه جلبک پر سرعت (HRAP) حاوی گونه میکروجلبک Coelastrum sp میتواند 64 PPCPs شامل 33 آنتیبیوتیک (با میانگین غلظت 223 میکروگرم در لیتر) از فاضلاب شهری حذف کند؛ در حالی که میانگین حذف آنتیبیوتیک در مقایسه با استفاده از فرایند مرسوم لجن فعال در طی یک فرایند شش ماهه بهطور متوسط 5 تا 50 درصد بیشتر است. در سه سال گذشته تعداد انتشارات مربوط به فرایندهای مبتنی بر ریزجلبیک ها برای حذف آنتیبیوتیک ها افزایش یافته است (شکل 1). هدف از بررسی حاضر ارائه خلاصهای جامع از پیشرفتهای اخیر فرایند حذف آنتیبیوتیک های مبتنی بر ریزجلبک ها با تمرکز ویژه بر بازده حذف و ساز و کارها است. محدودیت فعلی در این زمینه و چشمانداز تحقیقات آینده نیز مورد بحث قرار گرفته است.
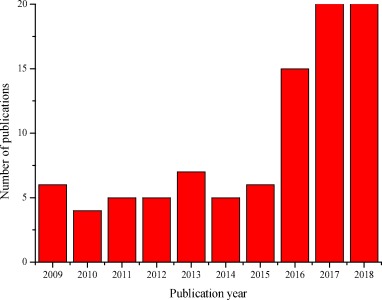
شکل 1.تعداد نشریات مرتبط با موضوع میکروجلبک و آنتیبیوتیک و تصفیه یا حذف
مهار ریزجلبک توسط آنتیبیوتیک ها
مهار ریزجلبک های تحریک شده توسط آنتیبیوتیک، عاملی مهم است که در توسعه فرایندهای حذف آنتیبیوتیک مبتنی بر ریزجلبک ها باید در نظر گرفته شود. آنتیبیوتیک ها ممکن است از طریق مهار سنتز مواد شیمیایی مانند کلروفیل a و رنگدانهها و مهار فعالیت آنزیمهایی مانند کاتالاز و سوپراکسید دیسموتاز بر رشد ریزجلبک ها اثر بگذارند. گزارش شده است که آنتیبیوتیک های کاناماسین و تتراسایکلین از طریق تنظیم سنتز پروتئین خود مانع رشد و فعالیت فتوسنتزی گونههای ریزجلبک Dictyosphaerium pulchellum و Micractinium pusillum میشوند. همچنین کاهش فعالیت فتوسنتزی گونه کلرلا ولگاریس با قرارگیری در معرض آنتیبیوتیک استرپتومایسین مشاهده شده است.
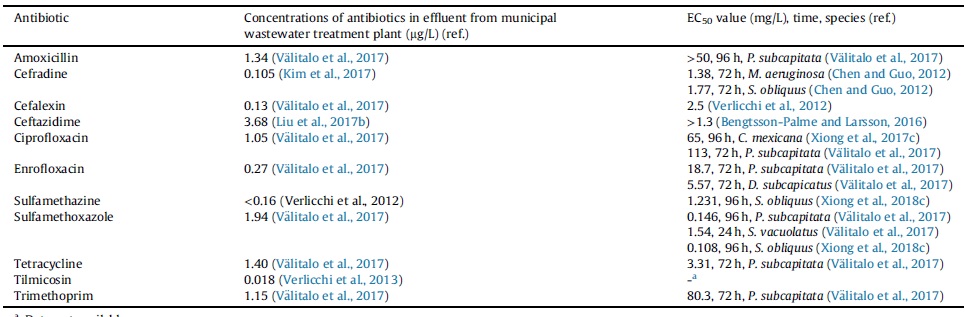
برخی از گونههای ریزجلبک مانند P. subcapitata ،C. vulgaris ،S. vacuolatus و Desmodesmus subspicatus به آنتیبیوتیک ها حساس هستند، از این رو بهطور گسترده بهعنوان نشانگرهای زیستی برای نظارت بر میزان آلودگی آنتیبیوتیک ها در محیط استفاده میشوند. اثر مهار آنتیبیوتیک ها بر روی ریزجلبک ها معمولاً از طریق غلظت مؤثر حداکثر نصف EC50 اندازهگیری میشود که بهعنوان غلظتی از آنتیبیوتیک که در آن 50 درصد رشد ریزجلبک مهار شده، تعریف میشود. بیشتر آنتیبیوتیک ها دارای مقادیر EC50 چندین مرتبه بالاتر از غلظت موجود در فاضلاب یا آبهای سطحی و زیرزمینی هستند؛ این نشان میدهد که ریزجلبک ها بهطور کلی مقاومت خوبی در برابر آنتیبیوتیک ها دارند.
بهعنوان مثال غلظت آنتیبیوتیک های سیپروفلوکساسین، تتراسایکلین و سولفامتوکسازول موجود در فاضلاب شهری تقریباً 1 میکروگرم بر لیتر است؛ در حالی که مقادیر EC50 این آنتیبیوتیک ها بهترتیب برابر 65 (گونه C. mexicana)، مقدار 3.31 (P. subcapitata) و 0.146 (P. subcapitata) میلیگرم بر لیتر است. بهطور کلی مقدار EC50 یک آنتیبیوتیک به گونههای خاص آنتیبیوتیک و ریزجلبک ها بستگی دارد. بهعنوان مثال آنتیبیوتیک سولفامون متیوکسین دارای مقدار EC50 برابر 5.9 میلیگرم بر لیتر در گونه ریزجلبک C. vulgaris و 9.7 میلیگرم بر لیتر در گونه ریزجلبک Isochrysis galbana است.
برای ریزجلبک P. subcapitata ارزش EC50 آنتیبیوتیک های سیپروفلوکساسین و جنتامایسین بهترتیب برابر 11.3 و 12.9 میلیگرم بر لیتر است. در حالی که آنتیبیوتیک های سفالوتین و ونکومایسین مقادیر EC50 بسیار بالاتر نشان میدهند که نشاندهنده مقاومت قوی گونه ریزجلبک P. subcapitata در برابر این دو آنتیبیوتیک است. جدول 1 غلظت آنتیبیوتیک هایی که معمولاً در پساب WWTPs وجود دارند و مقادیر EC50 آنتیبیوتیک ها در گونههای خاص جلبک را خلاصه میکند. از آنجا که غلظت آنتیبیوتیک ها در پساب WWTPs چندین مرتبه کمتر از مقدار EC50 است، استفاده از ریزجلبک ها برای تصفیه آنتیبیوتیک ها ممکن است پس از توسعه فرایند امکانپذیر باشد.
جدول 1. غلظت آنتیبیوتیک های منتخب در محیط و اثرات ecotoxicological
بهطور کلی اثر مهارکنندگی آنتیبیوتیک های ترکیبی میتواند شدیدتر از اثر یک آنتیبیوتیک منفرد باشد. بهعنوان مثال مقادیر h-96 EC50 آنتیبیوتیک های اریترومایسین، enrofloxacin و مخلوط اریترومایسین-enrofloxacin بر گونه ریزجلبک C. vulgaris بهترتیب برابر 85.7، 124.5 و 39.9 میلیگرم بر لیتر است که نشاندهنده اثر مشترک همافزایی دو آنتیبیوتیک است. اثر مهارکنندگی مخلوط آنتیبیوتیک های سولفامتوکسازول و تریمتوپریم بر گونه ریزجلبک N. oculate نیز بهطور قابلتوجهی بالاتر از اثر منفرد هر یک از آنتیبیوتیک ها بود. لازم به ذکر است که استفاده از مقدار EC50 مبتنی بر رشد برای ارزیابی سمیت آنتیبیوتیکی ممکن است جهانی نباشد.
سایر فعالیتهای ریزجلبک مانند فتوسنتز، فعالیتهای سیستم آنتیاکسیدانی و سنتز زیستی کاروتنوئید نیز میتوانند تحت تأثیر آنتیبیوتیک ها قرار بگیرند. بهعنوان مثال فعالیت فتوسنتز کلروفیتها میتوانند از رشد حساستر باشند، در نتیجه مقدار EC50 بر اساس میزان فتوسنتز Desmodesmus subspicatus تنها نیمی از EC50 بر اساس تعداد سلول (مبتنی بر رشد) بود. بنابراین اقدامات دیگری باید همراه با رشد سلولی انجام شود تا بینشی جامع در مورد اثرات آنتیبیوتیک ها بر روی جلبکها ارائه شود و پتانسیل دفع آنتیبیوتیک ها را نشان دهد.
عوامل مؤثر بر عملکرد حذف آنتیبیوتیک توسط ریزجلبک ها
در ادامه برخی از عوامل مؤثر بر عملکرد حذف آنتیبیوتیک توسط ریزجلبک ها از جمله تأثیر گونه ریزجلبک، نوع و غلظت آنتیبیوتیک و شرایط رشد گونه ریزجلبک توضیح داده میشود.
تأثیر گونه ریزجلبک
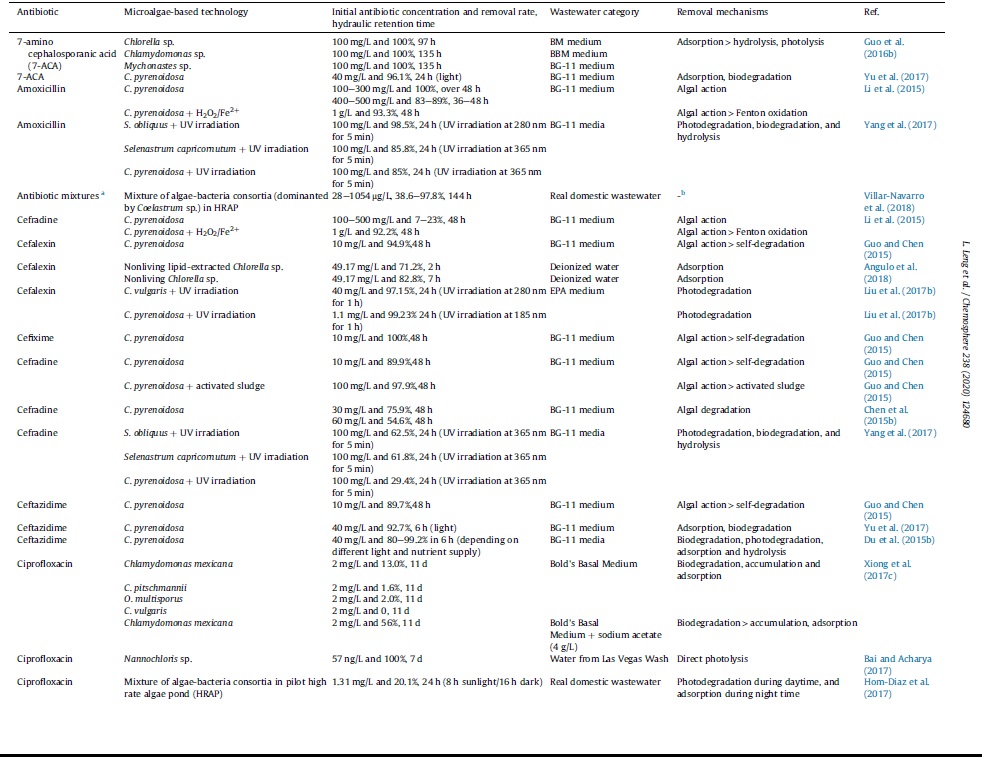
میزان حذف آنتیبیوتیک به گونههای ریزجلبک بستگی دارد. کلرلا برای حذف بسیاری از آنتیبیوتیک ها مؤثر است. بهعنوان مثال گونه C. pyrenoidosa معمولاً برای حذف آنتیبیوتیک های 7-آمینو سفالوسپوران اسید (7-ACA)، آموکسیسیلین، سفالکسین، سفیکسیم، سفرادین و سفتازیدیم استفاده میشود.
چدول 2. حذف آنتیبیوتیک مبتنی بر فناوری ریزجلبک و ساز و کارهای حذف
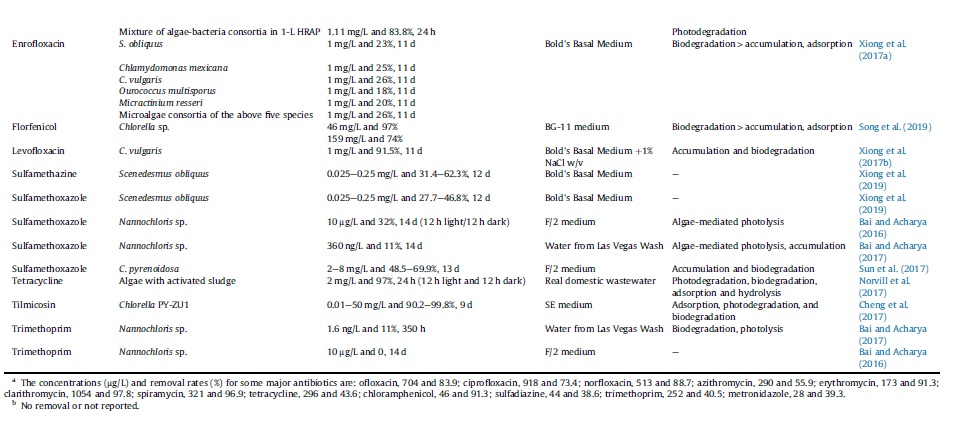
محققان با بررسی حذف آنتیبیوتیک levofloxacin توسط گونههای ریزجلبک C. vulgaris, Chlamydomonas mexicana, Chlamydomonas pitschmannii, Ourococcus multisporus, Micractinium resseri و Tribonema aequale گزارش کردند که گونه C. vulgaris نسبت به سایر گونهها میزان حذف بالاتری دارد. در مطالعهای دیگر گزارش شد که گونه C. vulgaris برای حذف آنتیبیوتیک enrofloxacin نسبت به گونههای S. obliquus, Chlamydomonas mexicana, Ourococcus multisporus و Micractinium resseri مؤثرتر است.
توسعه گونههای قوی ریزجلبک برای حذف آنتیبیوتیک ها با روشهای مختلفی قابل دستیابی است. یک استخر بزرگ از گونههای جلبک در طبیعت امکان جداسازی سویههای قوی برای تحمل آنتیبیوتیک ها را فراهم میکند. سیستمهای کشت حاوی گونههای متعدد جلبک با قابلیت حذف آنتیبیوتیک نیز میتوانند بهرهوری و پایداری سیستم حذف آنتیبیوتیک مبتنی بر ریزجلبک ها را افزایش دهند. علاوه بر این اصلاح ژنتیکی و تکامل متابولیکی گونه جلبک میتواند بازده حذف آنتیبیوتیک را تقویت کند. گزارش شده است که سازگاری ژنتیکی و فیزیولوژیکی به افزایش تحمل گونه ریزجلبک N. oceanica در مقابل آنتیبیوتیک Zeocin و افزایش حذف لووفلوکساسین توسط گونه C. vulgaris کمک میکند.
تأثیر نوع و غلظت آنتیبیوتیک
حذف آنتیبیوتیک مبتنی بر ریزجلبک به غلظت و نوع آنتیبیوتیک نیز وابسته است. هنگامی که غلظت نزدیک یا بالاتر از حد قابل تحمل جلبک باشد، بیشتر آنتیبیوتیک ها بر رشد جلبکها اثر میگذارند. از آنجا که معمولاً غلظت آنتیبیوتیک های مورد مطالعه در اندازه چند میلیگرم در لیتر تا صدها میلیگرم در لیتر هستند (جدول 2)، میزان حذف آنتیبیوتیک در مقدار پایین انتظار میرود. با این حال باید توجه داشت که افزایش غلظت آنتیبیوتیک در یک محدوده خاص تأثیر کمی در حذف آن داشته، اگر غلظت در حد قابل تحمل جلبک باشد. آنتیبیوتیک های مختلف دارای غلظتهای بحرانی متنوعی هستند.
بازده حذف آنتیبیوتیک ها توسط ریزجلبک ها به نوع آنتیبیوتیک ها نیز بستگی دارد. انواع مختلف آنتیبیوتیک، حتی در یک سطح غلظت مشابه، میتوانند منجر به ایجاد بازده حذف متفاوتی شوند. بهعنوان مثال ریزجلبک C. pyrenoidosa میتواند 83 الی 100 درصد آنتیبیوتیک آموکسیسیلین را حذف کند، اما تنها مقدار 7 الی 23 درصد از آنتیبیوتیک سفادین را حذف کند؛ اگرچه هر دو آنتیبیوتیک در غلظت یکسانی باشند. هنگامی که آنتیبیوتیک 7-ACA با غلظت 40 الی 100 میلیگرم بر لیتر تحت تصفیه گونههای ریزجلبک Chlorella sp. ،Chlamydomonas sp. Mychonastes sp یا C. pyrenoidosa قرار گرفت، میزان حذف 96 الی 100 درصدی حاصل شد.
با این حال تنها صفر الی 13 درصد آنتیبیوتیک سیپروفلوکساسین توسط گونههای ریزجلبک مانند Chlamydomonas mexicana pitschmannii ،O. multisporus یا C. vulgaris حذف شد؛ اگرچه غلظت در سطح نسبتاً کم (2mg/L) بود. قابل ذکر است که وجود چندین نوع آنتیبیوتیک ممکن است باعث افزایش بازده حذف آنها شود. بهعنوان مثال هنگامی که از ریزجلبک S. obliquus برای حذف آنتیبیوتیک سولفاماتازین استفاده شد و یک آنتیبیوتیک سولفامتوکسازول نیز به سیستم اضافه شد میزان حذف آن از میزان 18.5 الی 23.6 درصد حذف به 38.2 الی 51.8 درصد افزایش یافت. سولفامتوکسازول میتواند فعالیت آنزیم سیتوکروم P450 مانند آمینوپیرین N-demethylase و آنیلین هیدروکسیلاز را افزایش دهد که ممکن است نسبت به سولفامتوکسازول نزدیکی بیشتری نسبت به سولفامازازین داشته باشد.
تأثیر شرایط رشد ریزجلبک
شرایط رشد ریزجلبک ها از جمله مواد مغذی، پیهاش، روشنایی، دما، غلظت دیاکسید کربن، شوری، طراحی فوتوبیواکتور، اکسیژن محلول و مهارکنندههای رشد جلبک در بازدهی حذف آنتیبیوتیک بسیار مؤثر هستند. بهطور کلی شرایط مطلوب رشد جلبک در حذف آنتیبیوتیک ها مؤثر است.
افزودن مواد مغذی مناسب میتواند متابولیسم رشد جلبک را تقویت کند و منجر به افزایش عملکرد حذف آنتیبیوتیک شود. بهعنوان مثال افزودن 4g/L سدیماستات به کشت ریزجلبک Chlamydomonas Mexicoana باعث افزایش بیش از سه برابری حذف آنتیبیوتیک سیپروفلوکساسین و افزودن NaCl (یک درصد وزنی) به گونه C. vulgaris باعث افزایش حذف سه برابری آنتیبیوتیک لووفلوکساسین نسبت به شرایط کنترلی شد. همچنین گزارش شده است که حذف آنتیبیوتیک لووفلوکساسین توسط گونه S. obliquus با افزایش شوری از 0 به 171mM میتواند از 4.5 درصد به 93.4 درصد افزایش یابد.
مقدار پیهاش سیستم رشد جلبک میتواند واسطه هیدرولیز برخی آنتیبیوتیک های یونی باشد، بنابراین پیهاش در بازده حذف آنتیبیوتیک ها بسیار مهم است. پیهاش قلیایی میتواند حالت یونی تتراسایکلین را که بهدلیل هیدرولیز شدن این آنتیبیوتیک است، تغییر دهد؛ و باعث افزایش بازده حذف آن شود. با این حال مشاهده شد که تغییرات پیهاش میزان حذف آنتیبیوتیک 7-ACA را تحت تأثیر قرار نمیدهد، زیرا 7-ACA در محدوده 8.0-6.3=pH نسبتاً پایدار است.
نوردهی باعث تجزیه نوری آنتیبیوتیک ها میشود، از این رو میتوان از آن برای بهبود بازده حذف آنتیبیوتیک ها استفاده کرد. تابش نور شدید همچنین میتواند اکسیژن و پیهاش محلول را بهدلیل افزایش فتوسنتز ریزجلبک ها افزایش دهد که بهنوبه خود باعث تولید گونههای اکسیژن واکنشپذیر و افزایش حذف تتراسایکلین میشود.
سایر شرایط رشد جلبک نیز نقش مهمی در حذف آنتیبیوتیک ها دارند. گزارش شده است که طی یک عمل شش ماهه در HRAP، افزایش دمای 10 درجه سانتیگراد و تابش با شدت 20MJ/M2/d باعث افزایش چشمگیر حذف آنتیبیوتیک هایی از قبیل آلوکساسین، سیپروفلوکساسین و نورفلوکساسین میشود. میزان تلقیح و مدت زمان احتباس هیدرولیک سیستم رشد ریزجلبک ها نیز باید بر اساس غلظت آنتیبیوتیک و گونههای جلبک تنظیم شود. علاوه بر این، جلبکها میتوانند از یک مرحله تأخیر طولانی برای انطباق خود با یک محیط بسیار سخت مانند افزایش شدید غلظت تتراسایکلین از 1μg/L به 20mg/L و وجود ترکیبات مهاری مانند ترکیبات N-heterocyclic استفاده کنند.
مکانیسم حذف آنتیبیوتیک
ریزجلبک ها برای زنده ماندن در معرض آنتیبیوتیک ها و حذف آنها یک سری واکنش انجام میدهند. در طی فرایند، حذف جذب، تجمع، تجزیه زیستی، تجزیه نوری و هیدرولیز آنتیبیوتیک ها اتفاق میافتد (جدول 2 و شکل 2).
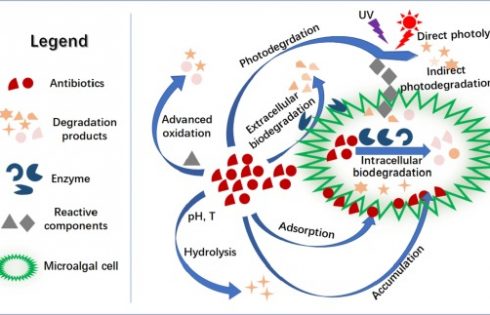
شکل 2. مکانیسم تجزیه آنتیبیوتیکها توسط میکروجلبک
جذب
جذب فرایند از بین بردن آلایندهها با اتصال غیرفعال آنها به ماده جامد است. حذف آنتیبیوتیک ها توسط مواد جاذب مانند biochar، کربنفعال و نانو مواد بهطور گسترده گزارش شده است. ریزجلبک ها میتوانند جاذب مؤثری برای حذف آنتیبیوتیک ها باشند. جذب توسط گروههای عملکردی و مجموعههای پلیمری (مشابه سلولز، همیسلولز و پروتئینها) بر روی دیوارههای سلولی جلبک انجام میشود و این یک فرایند خارجسلولی است. اثر فرایند جذب با استفاده از زیستتوده مرده جلبک برای جذب آنتیبیوتیک های قابل تشخیص است و عملکرد جذب بسته به آنتیبیوتیک های خاص و ریزجلبک ها بهدلیل خاصیت آبگریزی، عملکرد و ساختار متفاوت است. بهطور کلی مطلوب است که آنتیبیوتیک بیشتر دارای خاصیت آبگریزی باشد.
برخی از آنتیبیوتیک ها با فرایند جذب بهطور مؤثر از بین میروند. ظرفیت جذب بسیار بالا (295mg/g) هنگام استخراج لیپید از زیستتوده S. quadricauda در حذف آنتیبیوتیک تتراسایکلین بهدست آمد. همچنین جذب بهعنوان یکی از ساز و کارهای اصلی حذف تتراسایکلین در HRAP شناخته شده است. روند جذب بهطور کلی سریع است، بهعنوان مثال آنتیبیوتیک 7-ACA را میتوان با جذب میکروجلبکها در مدت زمان 10 دقیقه حذف کرد. جذب آنتیبیوتیک توسط زیستتوده ریزجلبک بهطور عمده از طریق پیوندهای هیدروژنی، جذب الکترواستاتیک، جداسازی و اثر آبگریزی حاصل میشود (شکل 3). در برخی مطالعات جذب، مکانیسم غالب حذف آنتیبیوتیک نیست اما میتواند بهعنوان اولین فرایند در ساز و کارهای حذف آنتیبیوتیک مبتنی بر ریزجلبک ها مانند تجمع و تجزیه بیولوژیکی عمل کند.
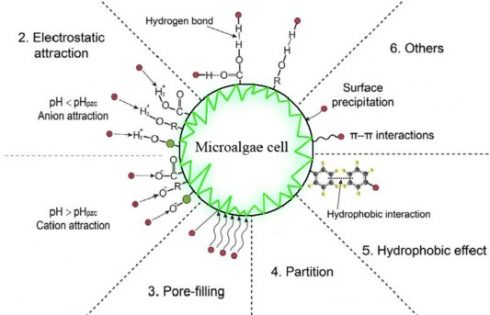
شکل 3. مکانیسم ممکن در طی جذب آنتیبیوتیکها
تجمع
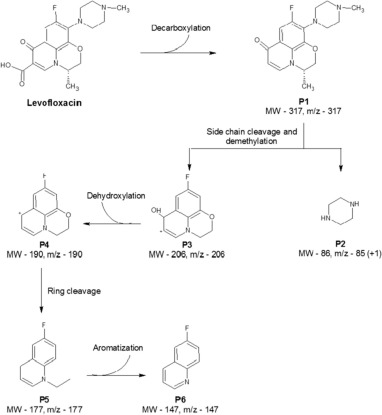
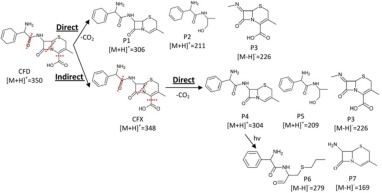
شکل 4. مسیرهای متابولیک ممکن در آنتیبیوتیک levofloxacin
تجزیه زیستی
تجزیه زیستی فرایند شکست آنتیبیوتیک توسط جلبک در داخل یا خارج از سلول را توصیف میکند، با این وجود برخی مشتقات شکستهشده توسط سلولهای جلبک بیشتر مصرف میشوند. نمونهای از این مکانیسم تخریب داخلسلولی آنتیبیوتیک ceftazidime و ساختار اصلی خانواده آن یعنی آنتیبیوتیک 7-ACA توسط گونه C. pyrenoidosa است. در این فرایند حذف آنتیبیوتیک ها در سه مرحله انجام شد، ابتدا آنتیبیوتیک ceftazidime توسط جلبکها جذب، سپس به آهستگی به دیواره سلولی جلبک منتقل و سرانجام توسط آنزیمهای جلبک شکسته میشود. در فرایند تخریب خارجسلولی، آنتیبیوتیک توسط متابولیتهای جلبک مانند آنزیمهای خارجسلولی شکسته شده و واسطهها یا محصولات نهایی تولید شده توسط سلولهای جلبک متابولیزه میشوند. سهم ساز و کارهای داخل و خارج سلولی برای حذف آنتیبیوتیک، ممکن است با تجزیه و تحلیل واسطهها یا محصولات نهایی آنتیبیوتیک در محیط و زیستتوده و یا با استفاده از آنزیمهای خارجشده از جلبکها برای تخریب آنتیبیوتیک ها متفاوت باشد.
بر اساس ویژگیهای آنزیم، تجزیه بیولوژیکی آنتیبیوتیک را میتوان بهعنوان یک فرایند کاتالیز آنزیمی دو فازی تلقی کرد. در مرحله اول آنتیبیوتیک ها با استفاده از آنزیمهایی نظیر مونوکسیژناز و دیوکسیژناز میتوانند بهصورت هیدرولیز، اکسیده و یا به ترکیبات آبدوست بیشتر کاهش پیدا کنند در حالی که در مرحله دوم ترکیبات آبدوست توسط گروه دیگری از آنزیمها مانند گلوتاتیون-S-ترانسفراز میتوانند کاتالیز شوند تا مولکولهای کوچکتر با سمیت کمتر تولید کنند.
صرفنظر از ساز و کارهای مختلف حذف آنتیبیوتیک مورد بحث هیدرولیز، شکست زنجیره جانبی، هیدروکسیلاسیون، برش حلقه، demethylation، دکربوکسیلاسیون و دهیدروکسیلاسیون آنتیبیوتیک ها ممکن است در هنگام تجزیه بیولوژیکی آنتیبیوتیک رخ دهد. همانطور که در شکل 4 نشان داده شده است ساز و کارهای تجزیه زیستی آنتیبیوتیک لوافلوکساسین شامل برخی از این واکنشها است.
تجزیه نوری
تجزیه نوری آنتیبیوتیک ها شامل فوتولیز مستقیم ناشی از نور و تجزیه نوری غیرمستقیم آنها است که با اجزای واکنشی تولیدشده توسط جلبکها در حضور نور تحریک میشوند. بسیاری از آنتیبیوتیک ها در صورت وجود نور در شرایط عاری از جلبک با استفاده از نور مستقیم حذف میشوند. با مقایسه میزان حذف در روز و شب مشخص شد که 40 درصد از آنتیبیوتیک تتراسایکلین موجود در آب با نور مستقیم خورشید قابل حذف است. حذف آنتیبیوتیک هایی شامل تتراسایکلین، سیپروفلوکساسین، سفازولین و سفپیرین در سامانههای مختلف تصفیه فاضلاب مبتنی بر میکروجلبک توسط فتولیز مستقیم انجام شده است.
در صورت وجود جلبک در سیستم حذف برخی از آنتیبیوتیک ها از طریق تجزیه نوری غیرمستقیم قابل افزایش است. در طی تجزیه نوری غیرمستقیم گونههای اکسیژن فعال مانند رادیکال هیدروکسیل از اجزای جلبک ایجاد و منجر به تجزیه آنتیبیوتیک ها میشوند. بهعنوان مثال با حضور نور در کشت گونه C. vulgaris رادیکال هیدروکسیل ایجاد شد و در نتیجه اکسیداسیون سریع آنتیبیوتیک نورفلوکساسین ایجاد شد. در HRAP مبتنی بر جلبک-باکتری تتراسایکلین تقریباً بهدلیل تجزیه نوری غیرمستقیم توسط واسطه سلولهای مرده یا فعال جلبک حذف شد. تجزیه نوری غیرمستقیم همچنین به حذف آنتیبیوتیکهای سیپروفلوکساسین، سفالکسین و سفرادین کمک کرده است. هر دو روش تجزیه نوری مستقیم و غیرمستقیم در حذف سفیرادین نقش دارند. محصولات تجزیه نوری و مسیرهای تخریب آنتیبیوتیک سفیرادین در شکل 5 نشان داده شده است.
شکل 5. محصولات تجزیه نوری مستقیم و غی مستقیم و مسیرهای تجزیه cephradine
هیدرولیز
تجزیه برخی از آنتیبیوتیکها با هیدرولیز نیز قابل انجام است. لازم به ذکر است که واکنشهای هیدرولیز ناشی از متابولیتهای جلبک مانند آنزیمها (هیدرولیز آنزیمی) نیز میتوانند بهعنوان فرایندهای تخریبزدایی در نظر گرفته شوند. هیدرولیز آنتیبیوتیک 7-ACA در حذف آنتیبیوتیک β- لاکتام بهدلیل واکنش باز شدن حلقه ساختار β- لاکتام کمک کرده است. مسیرهای هیدرولیز آمپیسیلین آنتیبیوتیک β- لاکتام بسته به پیهاش و درجه حرارت آبی بهطور قابل توجهی متفاوت است (شکل 6)، با افزایش پیهاش و دما میتوان میزان هیدرولیز را به میزان قابلتوجهی افزایش داد. توجه داشته باشید که رشد جلبکها ممکن است پیهاش کشت را تغییر دهد، افزایش پیهاش بهدلیل فعالیت فتوسنتزی ریزجلبک ها، هیدرولیز آنتیبیوتیک های حساس به پیهاش را تا حد زیادی تحت تأثیر این جلبکها قرار میدهد.
اکنش هیدرولیز قطبیت و آبگریزی آنتیبیوتیک ها را افزایش داده، بنابراین انحلال آنتیبیوتیک ها و تخریب زیستی بعدی آن توسط ریزجلبک ها را تسهیل میکند. برخی از آنتیبیوتیک ها مانند فلوئوروکینولونها و سولفونامیدها در برابر هیدرولیز مقاوم هستند.
ادغام حذف آنتیبیوتیک مبتنی بر ریزجلبک با فناوریهای دیگر
فناوری حذف آنتیبیوتیک قابلیت ادغام با دیگر فناوریها از جمله تابش ماوراء بنفش، فرایندهای اکسیداسیون پیشرفته و ادغام با سایر میکروارگانیسمها را دارد. ادغام این فناوریها با یکدیگر میتواند به بازدهی بیشتر فرایند حذف آنتیبیوتیک ها کمک کند.
تابش ماوراء بنفش (UV)
تابش اشعه ماوراء بنفش معمولاً بهعنوان یک مرحله ضدعفونی در تصفیه فاضلاب استفاده میشود و میتواند با تجزیه مستقیم و غیرمستقیم باعث حذف آنتیبیوتیک شود. میتوان آنتیبیوتیک های حساس به نور را با تابش اشعه ماوراء بنفش از طریق فوتولیز مستقیم حذف کرد. در طول تابش اشعه ماوراء بنفش آنتیبیوتیک ها فوتونهایی را جذب میکنند که میتوانند برخی پیوندهای شیمیایی آنها را بشکنند. محصولات بهدست آمده در برابر تجزیه بیولوژیکی ریزجلبک آسیبپذیر هستند. مشاهده شد که بیش از 73 درصد از آنتیبیوتیک سفادین (غلظت اولیه 150 میلیگرم در لیتر) با تابش اشعه ماوراء بنفش حذف میشود.
تابش اشعه ماوراء بنفش را میتوان با تصفیه توسط ریزجلبک ها برای تقویت تخریب آنتیبیوتیک از طریق تجزیه نوری غیرمستقیم ترکیب کرد. از آنجا که اشعه ماوراء بنفش در فاضلاب به سرعت در محدوده چند سانتیمتر تا ده متر کاهش مییابد، تخریب غیرمستقیم میتواند ساز و کار اصلی برای حذف آنتیبیوتیک ها باشد. اگرچه جلبک C. pyrenoidosa برای حذف آنتیبیوتیک سفادین (<20 درصد) ناکارآمد بود اما تابش یکپارچه جلبک-UV به میزان حذف بالای سفادین (> 78 درصد) و کاهش سمیت پساب تا بیش از 50 درصد منجر شد. با این حال لازم به ذکر است که تابش اشعه ماوراء بنفش (280 الی 320 نانومتر) ممکن است اثر منفی بر رشد جلبک و ترکیبات بیوشیمیایی داشته باشد. استفاده از گونههای جلبک جهشیافته با اشعه ماوراء بنفش ممکن است برای جلوگیری از اثر منفی اشعه ماوراء بنفش بر روی جلبکها مطلوب باشد.
فرایندهای اکسیداسیون پیشرفته
فرایندهای اکسیداسیون پیشرفته (AOPs) بهعنوان یک مرحله پیشتصفیه برای افزایش کارایی تصفیه فاضلاب حاوی ترکیبات آلی دارای خاصیت برگشتی مانند آنتیبیوتیک ها توسعه داده شده است. در طی تصفیه AOPs-جلبکها، آنتیبیوتیک ها را میتوان مستقیماً با واکنشهای اکسیداسیون از بین برد. بهعنوان مثال حذف آنتیبیوتیک های آموکسیسیلین و سفادین توسط ریزجلبک ها از 7.4 به 22.5 درصد و به بیش از 90 درصد در هنگام اتصال واکنشهای فنتون بر پایه (H2O2/Fe (II افزایش یافت. واکنشهای فنتون قابلیت تجزیهپذیری واسطههای تولیدشده توسط اکسیداسیون پیشرفته آنتیبیوتیک ها را افزایش دادند.
از طرف دیگر آنتیبیوتیک ها میتوانند با استفاده از تجزیه نوری غیرمستقیم ناشی از AOPها از بین بروند. بهعنوان مثال وجود آهن واکنشپذیر فتوشیمیایی (III) میتواند تشکیل گونههای اکسیژنی فعال که بهنوبه خود باعث حذف آنتیبیوتیک توسط ریزجلبک ها می شود را القاء کند. علاوه بر این، آهن (III) میتواند باعث تجزیه نوری آنتیبیوتیک نورفلوکساسین توسط ریزجلبک ها شود. استفاده از سیستم ریزجلبک -آهن (III) برای حذف مؤثر دو آنتیبیوتیک فلوروکینولون، آنروفلوکساسین و سیپروفلوکساسین هیدروکلراید گزارش شده است. با این حال، هنگام استفاده از معرفهای فنتون در حذف آنتیبیوتیک های مبتنی بر جلبکها میزان معرفهای فنتون باید بهطور ظریف تنظیم شود زیرا غلظتهای زیاد H2O2 یا (Fe (II میتواند برای ریزجلبک ها کشنده باشد.
ادغام با سایر میکروارگانیسمها
با استفاده از میکروارگانیسمهای دیگر مانند باکتریها و قارچها، عملکرد حذف آنتیبیوتیک توسط ریزجلبک ها قابل افزایش است. بسیاری از سویههای باکتریایی قادر به حذف آنتیبیوتیک ها هستند. بهعنوان مثال آنتیبیوتیک های سولفاپیریدین و سولفاتیازول بهطور مؤثر توسط باکتریهای Escherichia sp HS21 یا Acinetobacter sp. HS51 تجزیه میشوند. آنتیبیوتیک سولفامتوکسازول بهدلیل کارایی متابولیکی حذف زیستی جلبکهای مؤثر توسط سودوموناس HA-4 حذف شد. تجزیه زیستی سریع سیپروفلوکساسین توسط Thermus sp جدا شده از لجن دارویی نیز گزارش شده است.
استفاده از کنسرسیومهای جلبک-باکتریایی برای حذف آلایندههای خطرناک علاقه فزایندهای را به خود جلب کرده است. در رابطه همزیستی جلبک-باکتریایی اکسیژن مورد نیاز برای باکتریها را میتوان در حضور نور و دیاکسید کربن توسط ریزجلبک ها تولید کرد که در هنگام اکسیداسیون ماده آلی توسط باکتریها تولید میشود. سایر تعاملات بین این میکروارگانیسمها شامل تعاملهای دوستانه مانند استفاده از ریزجلبک ها بهعنوان زیستگاه محافظت از باکتریها برای تقویت رشد باکتریها است. علاوه بر این ممکن است برهمکنشهای رقابتی احتمالی مانند اثرات منفی بر روی یکدیگر، بهعنوان مثال دفع مواد ضدعفونیکننده یا ضد باکتری توسط ریزجلبک ها انجام شود.
یک سیستم ادغام لجن فعال شده پیرونوئیدوزا برای حذف مؤثر آنتیبیوتیک سفادین استفاده شد و بازده حذف 97.9 درصد بهدست آمد. پیشتصفیه فاضلاب حاوی آموکسیسیلین به میزان 150 میلیگرم در لیتر توسط کنسرسیوم Chlorella sp-باکتریها در رسوبات تالاب یا لجن فعال شده باعث حذف بیش از 99 درصدی آنتیبیوتیک شد. محصولات تخریب آنتیبیوتیک از جلبکها ممکن است برای باکتریها تخریبپذیر باشند و برعکس. ویژگیهای تخریب مکمل میکروارگانیسمهای متعدد و تبادل احتمالی محصولات تخریبکننده آنتیبیوتیک بین جلبکها و باکتریها ممکن است اثربخشی حذف آنتیبیوتیک ها را افزایش داده باشد. با این حال فتوبیوراکتورهای حاوی کشت مخلوط میکروجلبک و باکتریها برای حذف آنتیبیوتیک تتراسایکلین در غلظتهای بالا مؤثر نبودند. علاوه بر باکتریها، قارچ نامزد دیگری برای کمک به رفع آنتیبیوتیک با جلبکهاست. بهعنوان مثال حذف آنتیبیوتیک رانیتیدین توسط گونه C. vulgaris-Aspergillus niger biopellets مؤثر گزارش شد.
همکاری انواع گونههای میکروبی متعدد و همکاری میکروجلبکها با باکتری یا قارچ ممکن است برای تصفیه فاضلابهای آنتیبیوتیکی مقرون به صرفه تر باشد. ریزجلبک ها پس از کشت با باکتریها و قارچها بهراحتی میتوانند برداشت شوند. استفاده یکپارچه از ریزجلبک ها با سایر میکروارگانیسمها وابسته به ارزش بررسیهای بیشتر است. از سوی دیگر این که آیا کشت همگام میتواند در کاهش ژنهای مقاوم به آنتیبیوتیک ها نقش داشته باشد نیز یک تحقیق مهم در مورد این فناوری است.
تحقیقات مورد نیاز
با وجود توسعه تحقیقات در مورد فرایند حذف آنتیبیوتیک مبتنی بر ریزجلبک ها، هنوز به تحقیقاتی جدید برای توسعه این فرایندها نیاز است. از جمله تحقیقات مورد نیاز به بررسی تأثیر حذف همزمان چند آنتیبیوتیک، بررسی سمیت محصولات تجزیه شده و تجمع ژن مقاوم آنتیبیوتیکی میتوان اشاره کرد.
حذف همزمان چند آنتیبیوتیک
بسیاری از مطالعات بر روی حذف یک کلاس آنتیبیوتیکی متمرکز شدهاند. حذف آنتیبیوتیک های متعدد توسط ریزجلبک ها گاه به گاه مورد بررسی قرار میگیرد. با این حال در فاضلاب واقعی آنتیبیوتیک های متعدد و سایر آلایندهها به احتمال زیاد با هم همخوانی دارند. بهطور کلی بازده حذف آنتیبیوتیک وابسته به کرنش جلبک و کلاس خاص آنتیبیوتیک است. تعامل بین آنتیبیوتیک های مختلف یا بین آنتیبیوتیک ها و سایر مواد باعث میشود روند دفع ریزجلبک ها پیچیدهتر شود. تحقیقات آینده برای ارزیابی اثرات سو احتمالی چند آنتیبیوتیکی مورد نیاز است.
سمیت محصولات تجزیه شده
از بین بردن ترکیبات آنتیبیوتیکی ممکن است لزوماً منجر به از بین رفتن سمیت نگردد. بسته به ساختار و مسیرهای تخریب برخی از ترکیبات ثانویه ممکن است حتی از ترکیبات اصلی سمیتر باشند. بهعنوان مثال محصولات هیدرولیز آنتیبیوتیک های oxytetracycline و تتراسایکلین نسبت به آنتیبیوتیک های والد خود سمیتر بودند، بهطوری که نتایج حاصل از آزمایش سمیت حاد این آنتیبیوتیک ها و متابولیتهای هیدرولیز آنها با آزمایش Vibrio fischeri نشان داده شده است.
تجزیه نوری آنتیبیوتیک سفالوسپورین منجر به تولید ترکیباتی با سمیت بالاتر در آزمایش Vibrio fischer شد. بنابراین محصولات حاصل از تخریب آنتیبیوتیک باعث ایجاد نگرانی چشمگیری میشوند. نتایج سمیت بهدست آمده با استفاده از ریزجلبک نیز پدیده مشابهی را نشان داد. مسیرهای مختلف تخریب آنتیبیوتیک و محصولات تخریب همراه با پیچیدگی فاضلاب معمولاً مانع از بازده کامل حذف آنتیبیوتیک توسط ریزجلبک ها میشوند. مطالعات سیستماتیک در مسیرهای تخریب (ساز و کارهای حذف) و محصولات تخریب حاصل در تحقیقات آینده مورد نیاز است.
تجمع ژن مقاوم آنتیبیوتیکی
استفاده از زیستتوده ریزجلبک ها پس از تصفیه آنتیبیوتیکی موضوع دیگری است. مقاومت آنتیبیوتیکی، انتشار و تجمع ژن مقاوم به آنتیبیوتیک ها در محیط و زنجیرههای غذایی بهعنوان یک بحران جهانی در حال ظهور است، زیرا میتواند به بدن انسان منتقل شود و سلامت انسان را به خطر بیاندازد. زیستتوده برداشتشده برای ورود به زنجیره مواد غذایی توصیه نمیشود بلکه توصیه شده است با استفاده از روشهای گرما-شیمیایی برای حذف کامل آنتیبیوتیک ها پردازش شود.
نتیجهگیری
عملکرد کلی حذف آنتیبیوتیک بیانگر پتانسیل بسیار زیاد استفاده از فناوری مبتنی بر ریزجلبک برای تصفیه فاضلابهای حاوی آنتیبیوتیک است. آنتیبیوتیک ها میتوانند با جذب، تجمع، هیدرولیز، تجزیه بیولوژیکی و تجزیه نوری از بین بروند. بهینهسازی فرایند و ادغام آن با سایر روشهای درمانی مانند تابش اشعه ماوراء بنفش و اکسیداسیون پیشرفته و همکاری با باکتریها یا قارچها میتواند به فرایندی مؤثر برای حذف آنتیبیوتیک منجر شود.
در حال حاضر استفاده از ریزجلبک ها برای حذف آنتیبیوتیک ها هنوز در مرحله ابتدایی است. پتانسیل استفاده از فناوری مبتنی بر ریزجلبک ها برای حذف آنتیبیوتیک ها باید با استفاده از فاضلاب واقعی ارزیابی شود. حذف همزمان آلایندههای چند آنتیبیوتیکی و سایر آلایندهها، سمیت مواد واسطه و محصولات نهایی حاصل از تخریب آنتیبیوتیک ها و استفاده از زیستتوده برداشتشده جلبک هنوز در حال مطالعه است. عملکرد ارزیابی طولانیمدت نیز برای ارزیابی اثرات اکوسیستم تجمعی مورد نیاز است.
ترجمه: مژگان محبی